Artykuł
100 mln zł dotacji dla firm na prace B+R w branży medycznej
Konkurs Agencji Badań Medycznych wspierający producentów innowacyjnych wyrobów medycznych
Strefa Ulg i Dotacji (10/2022) | 1 kwietnia 2022 r.
Agencja Badań Medycznych przeznaczy 100 mln zł na dofinansowanie prac badawczo-rozwojowych (B+R) i innowacyjnych projektów w branży medycznej, realizowanych przez przedsiębiorstwa i konsorcja. Poznaj szczegóły i warunki uzyskania dotacji w ramach konkursu.
30 marca 2022 r. Agencja Badań Medycznych ogłosiła nabór wniosków o dofinansowanie realizowanych przez przedsiębiorstwa projektów mających na celu opracowanie, ocenę działania i ocenę kliniczną innowacyjnych wyrobów medycznych. Wnioski o dofinansowanie składać będzie można do 30 czerwca 2022 r. do godz. 12.00, a na dofinansowanie przeznaczono 100 mln PLN.
Konkurs ma na celu wsparcie producentów wyrobów medycznych klasy IIa, IIb, III oraz wyrobów medycznych do diagnostyki in vitro klasy B, C, D poszukujących nowych rozwiązań i nowych wskazań do stosowania rozwiązań już wprowadzonych do obrotu.
Dofinansowanie udzielane jest na realizację prac badawczo – rozwojowych: badania podstawowe, badania przemysłowe oraz prace rozwojowe oraz na usługi doradcze (wsparcie nieprzekraczające 2 mln EUR dostępnej jedynie dla podmiotów z sektora MŚP). Do wsparcia kwalifikują się projekty na każdym cyklu życia, wymagające przeprowadzenia oceny zgodności przy współpracy z certyfikowaną jednostką notyfikowaną.
- minimalna wartość projektu: 3 mln PLN,
- projekt musi rozpocząć się nie wcześniej, niż 01.09.2022 r. oraz nie później, niż 01.11.2022 r.,
- okres trwania projektu zakładającego przeprowadzenie badań klinicznych: od 33 do 72 miesięcy,
- okres trwania projektu, który nie zakłada przeprowadzenia badań klinicznych: od 10 do 36 miesięcy,
- projekt musi zakończyć się doprowadzeniem wyrobu będącego rezultatem projektu do produkcji seryjnej na terenie Unii Europejskiej / Europejskiego Obszaru Gospodarczego (wyprodukowanie minimum 2 serii) w ciągu 3 lat od zakończenia projektu, poprzez:
- wprowadzenie wyników projektu do produkcji seryjnej własnej wnioskodawcy i wprowadzenie wyrobu do obrotu,
- udzielenie licencji na zasadach rynkowych do korzystania z wyników projektu podmiotowi trzeciemu (przedsiębiorstwu) oraz uruchomienie produkcji seryjnej i wprowadzenie wyrobu do obrotu przez podmiot trzeci,
- sprzedaż na zasadach rynkowych praw do wyników projektu podmiotowi trzeciemu (przedsiębiorstwo) w celu uruchomienia produkcji seryjnej i wprowadzenie wyrobu do obrotu przez ten podmiot trzeci, przy czym sprzedaż tych wyników w celu ich dalszej odsprzedaży nie będzie uważana za komercjalizację wyników.
W przypadku lokalizacji produkcji poza Unią Europejską lub Europejskim Obszarem Gospodarczym konieczny jest zwrot dofinansowania.
W czasie trwania realizacji projektu oraz do 10 lat po jego zakończeniu Agencji Badań Medycznych przysługuje prawo:
- pierwokupu praw własności intelektualnej do rezultatów projektu, po cenach rynkowych,
- do zakupu po cenie rynkowej maksymalnie 50% całkowitej liczby wyrobów wytworzonych przez beneficjenta lub podmiot trzeci.
- przedsiębiorstwa: MŚP, duże przedsiębiorstwa, w tym przedsiębiorcy prowadzący badania naukowe i prace rozwojowe oraz ich jednostki organizacyjne posiadające osobowość prawną i siedzibę w Polsce,
- konsorcja składające się z maksymalnie 4 podmiotów, w których liderem jest przedsiębiorstwo, a konsorcjantami:
- uczelnie,
- federacje podmiotów systemu szkolnictwa wyższego i nauki,
- Polska Akademia Nauk,
- instytuty naukowe PAN,
- instytuty badawcze,
- międzynarodowe instytuty naukowe utworzone na podstawie odrębnych ustaw działające na terytorium Rzeczypospolitej Polskiej,
- inne podmioty prowadzące głównie działalność naukową w sposób samodzielny i ciągły,
- Centrum Medyczne Kształcenia Podyplomowego,
- podmioty lecznicze, dla których podmiotem tworzącym jest publiczna uczelnia medyczna albo uczelnia prowadząca działalność dydaktyczną i badawczą w dziedzinie nauk medycznych, albo Centrum Medyczne Kształcenia Podyplomowego,
- przedsiębiorcy mający status centrum badawczo-rozwojowego,
- prowadzące badania naukowe i prace rozwojowe jednostki organizacyjne posiadające osobowość prawną i siedzibę na terytorium Rzeczypospolitej Polskiej lub przedsiębiorstwa prowadzące działalność w innej formie organizacyjnej niż podmioty lecznicze, dla których podmiotem tworzącym jest publiczna uczelnia medyczna albo uczelnia prowadząca działalność dydaktyczną i badawczą w dziedzinie nauk medycznych.
Wymaga się, aby wnioskodawca bądź lider konsorcjum:
- prowadził działalność gospodarczą na terenie Polski (wymagane jest posiadanie przynajmniej oddziału lub zakładu),
- został zarejestrowany w rejestrze przedsiębiorców KRS minimum dwa lata przed złożeniem wniosku,
- prowadził działalność produkcyjną, która została wpisana do KRS minimum dwa lata przed złożeniem wniosku,
- wykazał, że przychód netto przedsiębiorstwa ze sprzedaży produktów, towarów i materiałów za dwa ostatnie lata obrotowe wynosi minimum 4 mln PLN (co do zasady na podstawie sprawozdań finansowych).
- koszty wynagrodzeń kadry naukowo-badawczej,
- koszty podwykonawstwa,
- koszty aparatury i sprzętu w zakresie i przez okres, w jakim są wykorzystywane przy realizacji projektu,
- koszty budynków i gruntów (m.in. laboratoria, pomieszczenia wykorzystywane do badań),
- pozostałe koszty bezpośrednie (m.in. koszty adaptacji budynków, materiałów do realizacji prac B+R, elementy służące do budowy i na stałe zainstalowane w prototypie, instalacji pilotażowej lub demonstracyjnej, koszty sprzętu laboratoryjnego, wynajmu laboratorium, certyfikatów niezbędnych do realizacji prac B+R, opłat związanych z dopuszczeniem do badań – URPL, Komisja Bioetyczna),
- koszty licencji na wykorzystanie / produkcję elementów wyrobu (koszty nabycia wartości niematerialnych i prawnych),
- koszty pośrednie, rozliczane metodą ryczałtową stanowiące 5% sumy kosztów wynagrodzeń, podwykonawstwa i licencji (koszty eksploatacyjno-administracyjne związane z obsługą projektu, w tym m.in. koszty wynagrodzenia kierownika i personelu administracyjnego, koszty promocji, utrzymania powierzchni biurowych).
Należy wskazać, że koszty związane z procesem oceny zgodności nie stanowią kosztów kwalifikowanych i nie będą finansowane przez Agencję.
Intensywność wsparcia jest ustala zgodnie z zasadami udzielania pomocy publicznej, w zależności od wnioskodawcy oraz rodzaju prac.
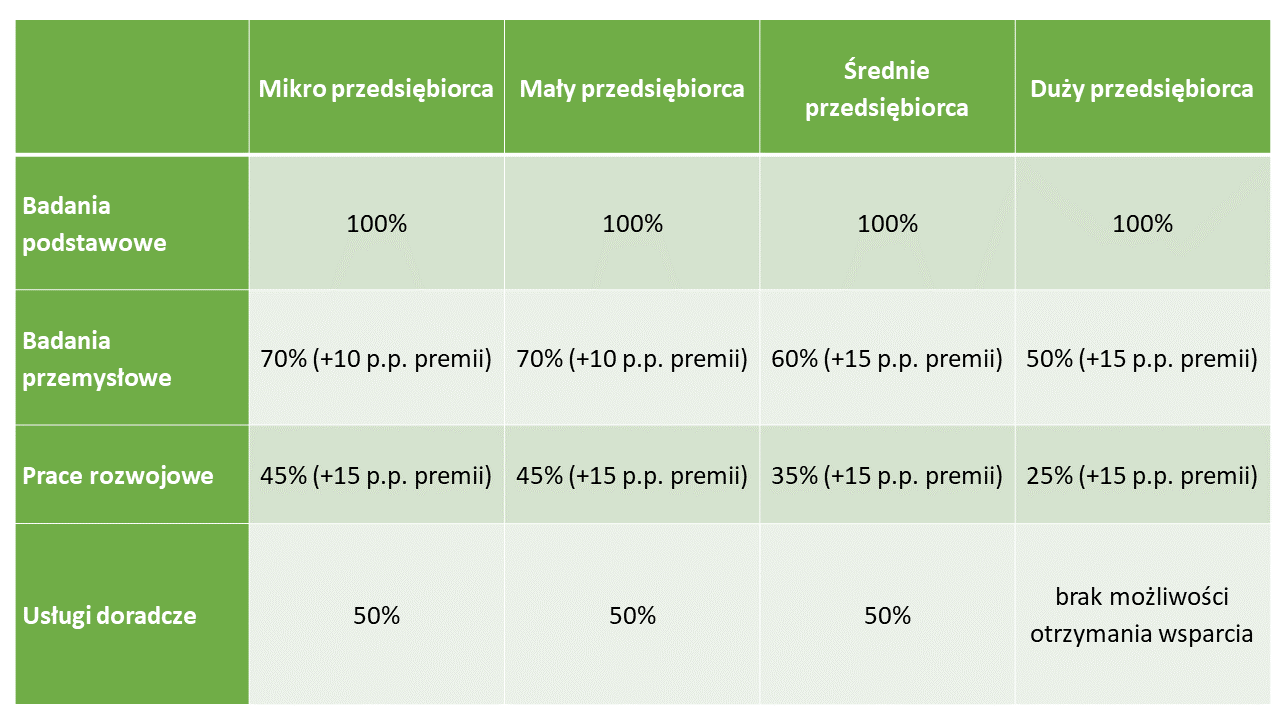
Intensywność wsparcia na badania przemysłowe i prace rozwojowe może zostać zwiększona (premia) w przypadku realizacji projektu w ramach tzw. skutecznej współpracy albo szerokiego rozpowszechnienia wyników projektu.
Wsparcie nie może przekroczyć:
- 40 mln EUR w przypadku, gdy co najmniej połowa kosztów dotyczy badań podstawowych,
- 20 mln EUR w przypadku, gdy co najmniej połowa kosztów dotyczy badań przemysłowych,
- 15 mln EUR w przypadku, gdy co najmniej połowa kosztów dotyczy prac rozwojowych.
- projekt dotyczy wyrobu będącego co najmniej na etapie prac rozwojowych (TRL 7-9),
- komercjalizacja wyrobu będzie odbywała się w ramach własnej działalności gospodarczej wnioskodawcy,
- wnioskodawca posiada certyfikaty na posiadanie systemów zarządzania jakością wyrobów medycznych/wyrobów medycznych do diagnostyki in vitro,
- działania diagnostyczne lub lecznicze wyrobu, którego dotyczy wniosek, opierają się o wykorzystanie algorytmów sztucznej inteligencji oraz robotyki,
- projekt obejmuje przeprowadzenie badania klinicznego wyrobu medycznego.





