Precision Medicine(プレシジョン・メディシン)の普及におけるコンパニオン診断の在り方・課題 ブックマークが追加されました

最新動向/市場予測
Precision Medicine(プレシジョン・メディシン)の普及におけるコンパニオン診断の在り方・課題
I. Precision Medicine:個人に最適な医療が提供される世界
Precision Medicineとは、個々の患者の遺伝子、環境、ライフスタイル等の特性に基づき、最も効果的で安全な治療法を選択する新しい医療アプローチであり、「プレシジョン・メディシン」、「精密医療」、「個別化医療」、「がんゲノム医療」等に訳されることもある。
米国オバマ政権が2015年にPrecision Medicine Initiative1を発表して以来、Precision Medicineには大きな関心が寄せられている。特定の病にかかった患者を疾患名で纏めて捉えてきた従来の医療アプローチと異なり、Precision Medicineは患者が持つ遺伝子情報等の生物学的特性を詳細に分析した上で、各患者にとって最適な医療を提供することを目指している。
Precision Medicineの普及により、各患者に必要な治療法をより正確かつ効率的に選択することが可能となり、医療の質の向上とともに、治療にかかる時間やコストの削減も期待できる。
II. 最適な治療提供の鍵:コンパニオン診断
Precision Medicineが普及した環境においては、治療薬などの有効性や副作用のリスクを患者ごとに判断して治療方針を決めるために、ゲノム情報をはじめとする患者の特性を把握する方法が必要不可欠となる。このような方法をコンパニオン診断と呼ぶ。
コンパニオン診断の概念は、1990年代のヒトゲノムプロジェクトの進展とともに登場した。当該プロジェクトでは、ヒトゲノム情報の医療への活用を目指しており、これを起点に、遺伝子変異と疾患の関連性を明らかにすることで、特定の遺伝子変異を持つ患者に対する医薬品の効果を予測できる新たな可能性が見出された。2000年代に入ると、前述の概念が具体的な形となり、乳がんのHER2遺伝子変異を標的とした治療薬トラスツズマブの効果を予測するためのコンパニオン診断薬(Companion diagnostics、以下CDx )等が登場した。その後、遺伝子の解析技術の進歩と共に、数多くのCDxが開発(2024年4月時点では、米国で承認されているCDxは59種類2、日本で承認されているCDxは44種類3)され、多様ながん種や遺伝性疾患の治療の選択にCDxが用いられている。これらのCDxの登場によって、治療薬などの有効性や副作用のリスクを個別に判断して患者に最適な治療方針を選択することが徐々に普及している。
III. 進化する技術 vs 技術を取り扱う制度上・運用上の課題
日本において、CDxが正式に定義されたのは2013年4である。それ以降、PCRや次世代シーケンシング(NGS)等を活用したCDxの開発が活発になり、複数の遺伝子を同時に検査可能なCDx(Multiplex、マルチプレックスと呼ばれる)なども登場した。特に病気の原因となる遺伝子、いわゆるドライバー遺伝子の解明が進んでいる肺がん等のがん種においては、CDxの開発が活発であり、スペックの異なる製品(検出可能な遺伝子、TATや検出精度など)が多数上市されている。
多種多様のCDxの登場によって、患者の遺伝子情報を明らかにするツールが医療現場に提供され、適切な治療薬を選択できる機会が増えているものの、本来患者が得られるはずの恩恵が限定的になっている場面(適切な治療薬を選択できないなど)がある。本稿では、国立医薬品食品衛生研究所遺伝子医薬部の井上貴雄先生、築茂由則先生へのインタビュー結果を踏まえて、当該状況の原因となっている現在開発・臨床運用における課題を整理した。
1. 開発における主要課題:製品間の互換性検証
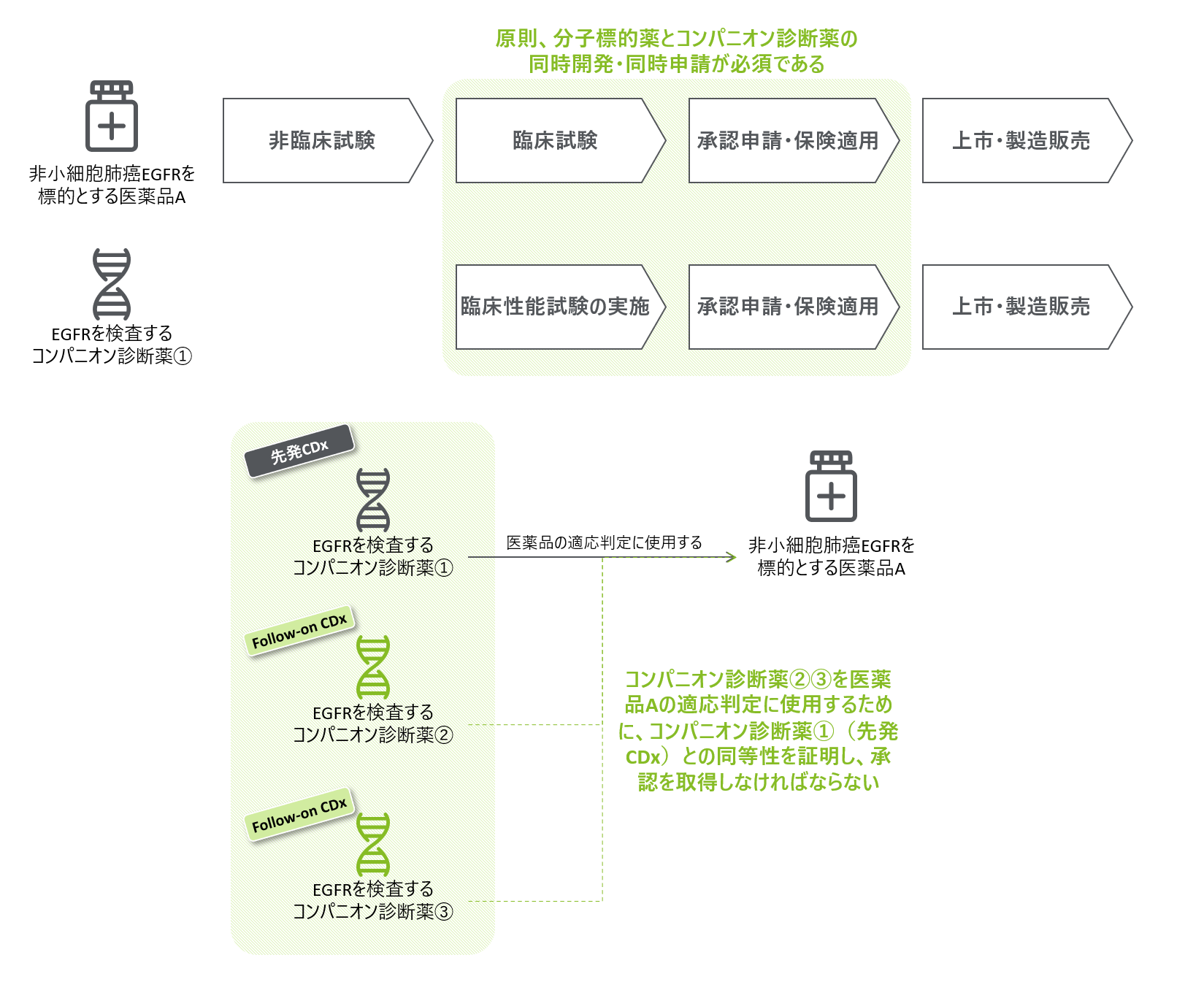
医薬品と同時に開発されたCDxをPrimary CDx、Primary CDxの後に登場したCDxをFollow-on CDxと呼ぶ。Primary CDxは、医薬品の有効性が確認された患者群の検出能力を医薬品の治験結果との整合性を分析する形で評価し、承認を取得する。一方で、Follow-on CDxでは、医薬品の治験実施時に採取・保存された検体(または治験と同一の条件で採取された検体)を用いて、医薬品の有効性が認められる患者群の検出能力を評価し、Primary CDxをはじめとする既承認品との同等性を示す必要がある(図1)。
図1 分子標的薬とCDxの関係
分子標的薬とターゲットとする遺伝子変異の種類が限定的であれば、全ての分子標的薬とCDxの組み合わせに対して前述の同等性試験を実施することによって、Primary CDx、Follow-on CDxに関わらず、全ての分子標的薬の適応判定ができる状況を形成しうる。しかし実際には、分子標的薬とターゲットとする遺伝子変異の組み合わせが多種多様であるため、上市された分子標的薬とFollow-on CDxの紐づけを網羅的かつタイムリーに行うことが不可能である。その結果、一部の医薬品のみに紐づくCDxが存在することになり、後述する保険償還の算定回数の制限も相まって、適切な医薬品への患者アクセスが制限される。
このように患者アクセスが制限される具体例は以下のとおりである。2024年4月時点で、非小細胞肺がん患者のうち、EGFR遺伝子変異陽性の患者を対象とした5種類の分子標的薬が上市されている。これらに紐づくCDxは7種類あるが、5種類の分子標的薬の全てに紐づいているCDxは一部にとどまっている(表1)。 例えば、肺癌マルチ遺伝子PCRパネル(以下、Amoyという)によってEGFR遺伝子変異陽性の結果が出たとしても、ダコミチニブの適応判定はできない。最初にAmoyを選択し遺伝子検査を受けた患者は、ダコミチニブを投与するためには、オンコマイン Dx Target Test マルチ CDxシステムのようなダコミチニブと紐づいているCDxで再度検査することが必要となる。しかし、現在の保険償還ルールにおいては、一部の特殊なケースを除き5、EGFR遺伝子検査は患者1人につき原則1回のみの算定となっており、薬剤の適応判定のために実施する二回目の検査は保険償還できない。つまり、現在の制度においては、Amoyを最初に使用した患者はダコミチニブを投与する機会を失うこととなる。
表1 非小細胞肺がん患者のうち、EGFR遺伝子変異が陽性の患者をターゲットとする医薬品とCDxの紐づき状況6(2024年4月時点)
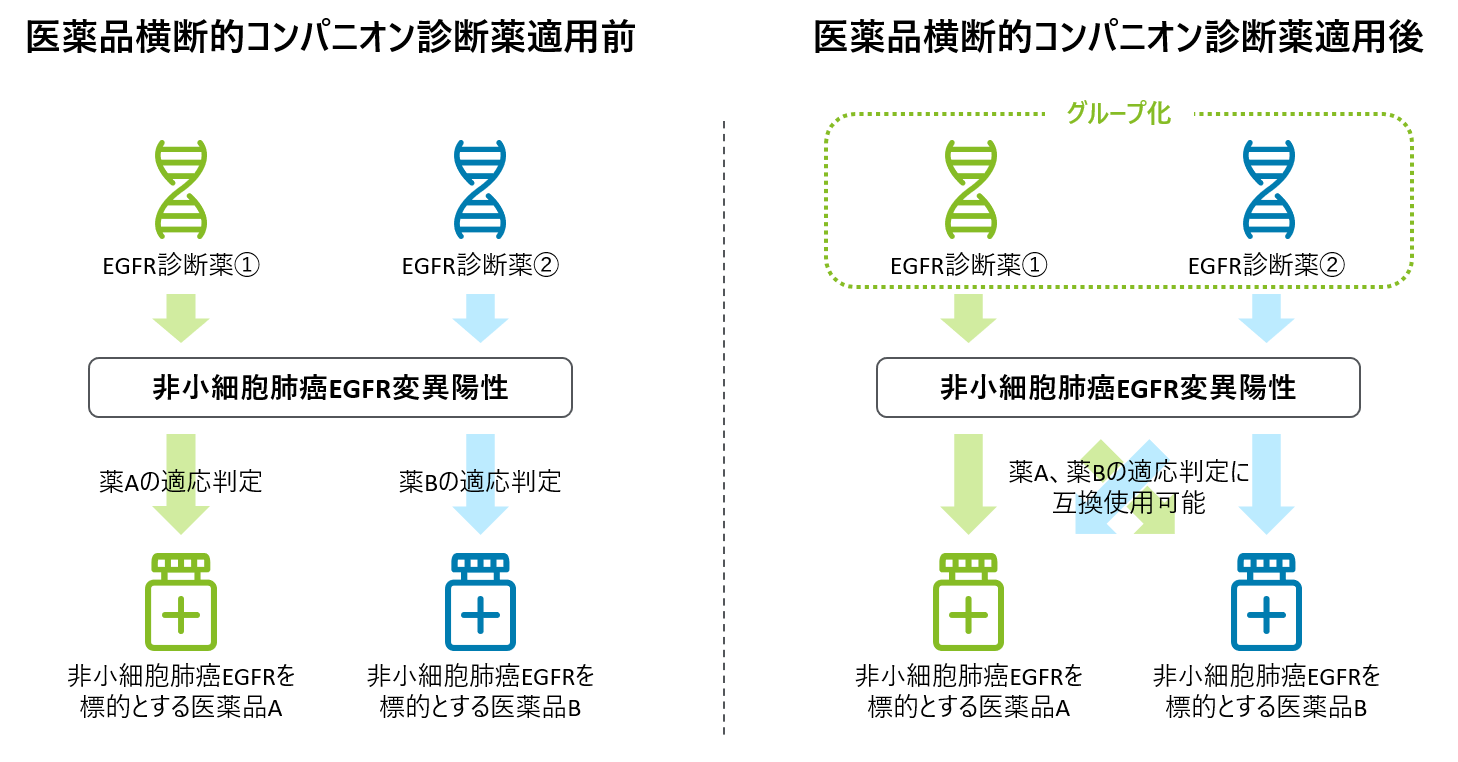
上記の課題を解決するためには、同一の遺伝子変異を対象とする分子標的薬とCDxが全て紐づくように制度上で整理する必要があり、CDx間で検査結果に大きな差異がないことを担保するためにも、同一の遺伝子変異を検査するCDx間の互換性を標準的に評価するプロセスが求められる。独立法人医薬品医療機器総合機構(PMDA)は2019年に「がんゲノム医療実装を見据えたコンパニオン診断薬等の規制のあり方」と題した合同ワークショップを開催し、日本製薬工業協会(JPMA)、欧州製薬団体連合会(EFPIA)、米国研究製薬工業協会(PhRMA)、日本臨床検査薬協会(JACRI)と共にCDxの医薬品横断的使用について意見交換を行った7。その後、約3年の検討を経て、厚生労働省は通知「医薬品横断的なコンパニオン診断を目的とする体外診断用医薬品等の取扱いについて」を2022年3月に発出した8。当該通知には同一の遺伝子変異を検査するCDxに対して、同一の分子標的薬を紐づけるための考え方や手続きが整理されている。図2で示すように、医薬品横断的CDxは、科学的に妥当と判断される範囲において、同一の遺伝子変異を標的とする全ての医薬品の適応判定に使用できるようになる。これを受けて肺癌学会は、EGFR遺伝子変異を対象としたCDxについて、前述の通知に基づいた対応を求める提案書を2023年5月にPMDAに提出した9。
図2 医薬品横断的CDxの仕組み
しかし、EGFR遺伝子変異をはじめとして、医薬品横断的CDxが実現された実例は一つもないというのが現状である。そのため、選択したCDxにより、患者の医薬品へのアクセスが依然として制限されうる状況である。
2. 臨床運用における主要課題
2.1 マルチプレックスの保険償還
上市されているマルチプレックスの中で、測定可能な項目数が多いものだと1回の検査で数百の遺伝子を解析できる。そのため、患者に適した分子標的薬を早期に特定できるということで多くの医師から支持されている。しかし、後述する保険償還上の課題によって、保険診療におけるマルチプレックスの活用が妨げられている可能性がある。
臨床的な有用性が認められたものを保険償還するという考えから、CDxでは、特定の医薬品と紐づく遺伝子項目のみが保険償還可能となっている。そのため、複数の遺伝子を同時に検査できるマルチプレックスの場合、特定の医薬品と紐づかない遺伝子項目については保険償還されず、保険償還額がマルチプレックスのコストに見合わない場合がある。
FoundationOne CDx がんゲノムプロファイル(以下、F1という)は1回の検査で324種の遺伝子変異を解析できるがんゲノムプロファイリング検査(以下、CGPという)であり、標的治療終了(又は終了見込み段階)で使用した場合にCGPとして44,000点(=44万円)を算定できる10。F1はCGPであると同時にCDxでも使用される場合があり、その場合には、特定の医薬品と紐づく遺伝子項目分のみの保険償還となる。例えば、非小細胞肺癌の患者を対象にF1でCDxを行った場合、CDxとして承認されているEGFR遺伝子変異、ALK融合遺伝子、ROS1融合遺伝子、MET遺伝子エクソン14スキッピング変異、NTRK融合遺伝子の5項目分である14,000点(=14万円)のみが保険償還される11。しかし、F1をCDxとして使用したとしても、実際の検査としては324種の遺伝子変異を解析しているため、1回の解析費用として44万円が病院に対して請求され、保険償還分との差額が病院の持ち出しになる(図3)。
図3 FoundationOne CDx がんゲノムプロファイルがCDxとして使用される場合の保険償還問題
特定のマルチプレックスにのみ測定可能な遺伝子変異項目があり、当該項目を検査することで適応判定が可能な医薬品が登場する可能性もある。しかし、CDxに関わる項目のみが償還され、上述したような病院の持ち出しが発生する場合には、CDxとしての使用を臨床現場が控える可能性があり、患者の医薬品へのアクセスが制限されることになる。そのため、患者の医薬品へのアクセス及び検査のコストの双方を考慮した保険償還の在り方をあらためて考える必要がある。
2.2 実臨床における試験実施の精度管理
分子標的薬の適応判定に必要不可欠なCDxは、高い検査精度が求められる。そのため、CDxの工程を担う臨床検査室(民間検査会社または院内臨床検査室)の信頼性保証は重要な課題となっている。検査者の能力、施設要件、精度管理等の多様な面から検査室の信頼性保証を評価する規格として、国際規格ISO15189や米国のCAPがあり、当該規格の認可を取得する検査機関が増えている。また、各検査室で取り扱うゲノムデータについては、PMDAから「ゲノム試料の収集及びゲノムデータの取扱いに関するガイドライン」が公開され、一貫した方法でのゲノム試料収集・研究実施が促進されている12。
このように、制度面において検査室の信頼性保証が高度化しているものの、人的エラーが入り込むリスクを完全に払拭することができない。例えば、採取した組織検体サンプルの質の評価や、In situ ハイブリダイゼーション(ISH)や免疫染色(IHC)のような病理診断における陽性判定のカットオフ値の設定等は、検査者の技量に依存しており、担当する検査者の技量に判定結果が依存してしまう可能性がある。従って、検体採取・試薬調製等をおこなう検査室においては、プロトコールの遵守、検査者の技術の向上による検査の質の均てん化が課題となっている。
IV. 産官学連携によるコンパニオン診断の使用環境改善
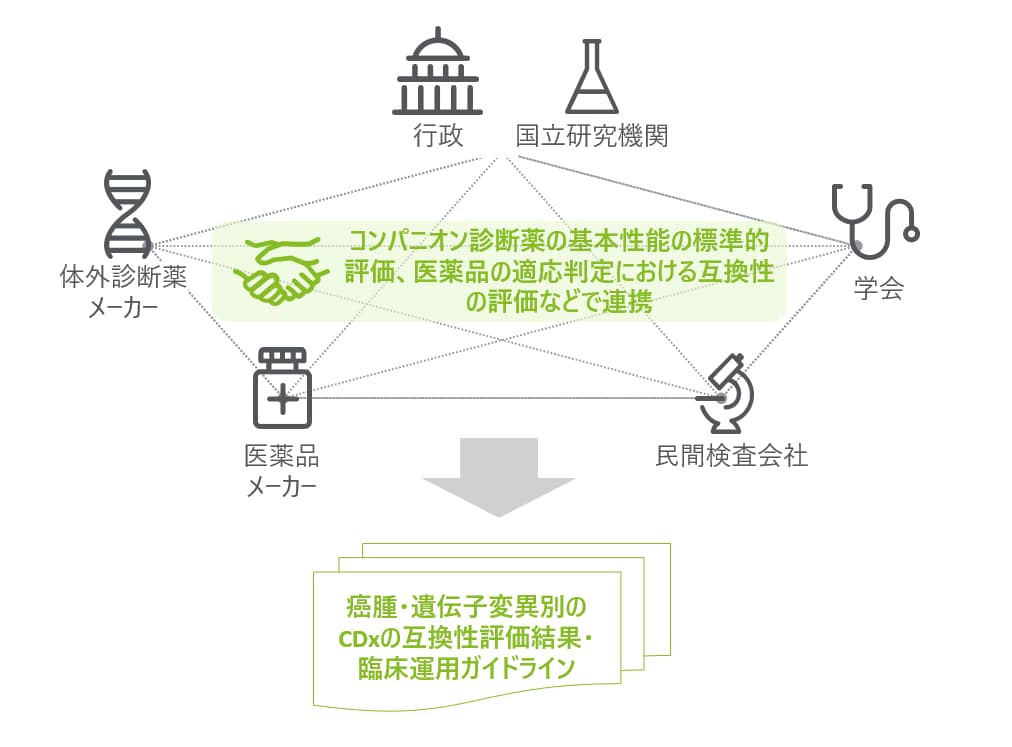
Precision Medicineの更なる普及が期待されている中で、CDxの重要度は日々高まっている。一方で前述したような開発・臨床運用での様々な課題が、CDxの適切な使用環境の構築を妨げている可能性があり、このような課題を解決するには、CDxを開発・製造するメーカーのみならず、医薬品メーカーや、臨床での検査を担う病院/民間検査会社、検査結果に基づき治療方針を決める医師、適切な医療環境を制度によって担保する行政等、複数のステークホルダーが連携して課題解決に取り組み必要がある。
例えば、医薬品横断的CDxの実現にあたっては、分子標的薬とCDxを銘柄ごとに紐づけて薬事承認せずとも、分子標的薬の適応判定において各CDxの精度が担保される仕組みが求められる。このような仕組みの構築にあたっては、同一の遺伝子変異に対する各CDxの基本性能・互換性を評価し、検査原理や検体種の差異を考慮した上で、適切なCDxの選択を補助する臨床運用ガイドラインを整備するといった打ち手などが考えられる。しかし、基本性能・互換性の評価に必要な遺伝子変異ごとの標準サンプル作成、CDxの性能評価等の作業は、多くのリソースが必要であり、医療現場や一企業では対応できない可能性が高いため、多くのステークホルダーが協力関係を築くことが求められる(図4)。また、米国やイギリスなどの国々においてもゲノム医療は注目テーマであり、遺伝子変異の検査の標準的評価においては同様の課題を持っている可能性が高いことから、解決に向けた検討を国内に閉じずに国際的な連携の中で行う余地がある。
図4 CDxの使用環境改善における産官学連携のイメージ
V. おわりに
Precision Medicineの更なる普及により患者が受益できる医療の質が向上されることが期待されるが、当該普及にはPrecision Medicineを支える基盤である検査環境の改善に注力しなければならない。そのためには前述した通り、医療に関わるステークホルダーの連携が必要不可欠であり、当社としても関連する各ステークホルダーと共に、真のPrecision Medicineの実現に引き続き貢献して参りたい。
本稿の作成にあたり、国立医薬品食品衛生研究所遺伝子医薬部の井上貴雄先生、築茂由則先生にご協力及びご助言を頂くことに感謝を申し上げます。
1. THE PRECISION MEDICINE INITIATIVE, the WHITE HOUSE PRESIDENT BARACK OBAMA HP: https://obamawhitehouse.archives.gov/precision-medicine(参照:2024年4月8日)
2. List of Cleared or Approved Companion Diagnostic Devices (In Vitro and Imaging Tools), FDAサイト:https://www.fda.gov/medical-devices/in-vitro-diagnostics/list-cleared-or-approved-companion-diagnostic-devices-in-vitro-and-imaging-tools#Group_Labeling(参照:2024年4月8日)
3. 独立行政法人医薬品医療機器総合機構 コンパニオン診断薬等の情報サイトに掲載される2024年3月26日版の承認状況を基に集計:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html(参照:2024年4月8日)
4. 厚生労働省医薬食品局審査管理課は平成25年7月1日に「(薬食審査発0701第10号)コンパニオン診断薬等及び関連する医薬品の承認申請に係る留意事項について」を発出し、コンパニオン診断薬の定義を明確化した。
5. D004-2 悪性腫瘍組織検査の留意事項によると、肺癌におけるEGFR遺伝子検査については、再発や増悪により、2次的遺伝子変異等が疑われ、再度治療法を選択する必要がある場合にも算定できることとし、マイクロサテライト不安定性検査については、リンチ症候群の診断の補助を目的とする場合又は固形癌の抗悪性腫瘍剤による治療法の選択を目的とする場合に、当該検査を実施した後に、もう一方の目的で当該検査を実施した場合にあっても、別に1回に限り算定できる。
厚生労働省 令和6年度診療報酬改定について(令和6年3月5日保医発0305第4号)診療報酬の算定方法の一部改正に伴う実施上の留意事項について(通知):https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000188411_00045.html(参照:2024年4月12日)
6. 独立行政法人医薬品医療機器総合機構 コンパニオン診断薬等の情報サイトに掲載される2024年3月26日版の承認状況を基に集計:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html(参照:2024年4月8日)
7. 独立行政法人医薬品医療機器総合機構 ワークショップ「がんゲノム医療実装を見据えたコンパニオン診断薬等の規制のあり方」の開催について:https://www.pmda.go.jp/review-services/symposia/0098.html(参照:2024年4月9日)
8. (薬生薬審発 0331第1号、薬生機審発0331第1号、薬生安発0331第1号)「医薬品横断的なコンパニオン診断を目的とする体外診断用医薬品等の取扱いについて」:https://www.pmda.go.jp/files/000246167.pdf(参照:2024年4月10日)
9. 独立行政法人医薬品医療機器総合機構 コンパニオン診断薬WG:https://www.pmda.go.jp/rs-std-jp/cross-sectional-project/0013.html(参照:2024年4月9日)
10. 厚生労働省 中央社会保険医療協議会 総会(第575回)議事次第 個別事項(その19)について:https://www.mhlw.go.jp/stf/shingi2/0000212500_00234.html(参照:2024年4月9日)
11. 日本肺癌学会バイオマーカー委員会 「肺癌患者における次世代シークエンサーを用いた遺伝子パネル検査の手引き」(2021年10月20日第2.0版)
D004-2 悪性腫瘍組織検査の留意事項によると、肺癌におけるEGFR遺伝子検査、ROS1融合遺伝子検査、ALK融合遺伝子検査3項目で6000点が算定でき、MET遺伝子エクソン14スキッピング変異(次世代シーケンシング)、固形癌におけるNTRK融合遺伝子検査2項目で8000点が算定できる。
厚生労働省 令和6年度診療報酬改定について(令和6年3月5日保医発0305第4号)診療報酬の算定方法の一部改正に伴う実施上の留意事項について(通知):https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000188411_00045.html(参照:2024年4月12日)
12. 独立行政法人医薬品医療機器総合機構 ICH-E18 ゲノム試料の収集及びゲノムデータの取扱い:https://www.pmda.go.jp/int-activities/int-harmony/ich/0023.html(参照:2024年4月9日)
お問い合わせ
お問い合わせフォームよりお問い合わせください。