医療エビデンス合成により、データから勝ち筋の糸口を見つける ブックマークが追加されました

ナレッジ
医療エビデンス合成により、データから勝ち筋の糸口を見つける
Society5.0の実現に向けた様々な取り組みに代表されるようなマクロ環境の変化に加え、医療分野においてもデジタル技術の活用促進やHealth Tech企業の市場参入などミクロ環境の変化も生じています。こうした変化に着実に適応していくためには、新たなエコシステムを構築するとともに、強力なエビデンスに基づいた意思決定を実施していくことが求められると考えられます。今回は、この強力なエビデンスの創出に着目し、1つの有用な手法である医療エビデンス合成についてご紹介いたします。
さらに重要になる「質の高いエビデンスの創出」
近年、デジタル技術の急速な発展に伴い、業界の枠組みも越えてデータの連携が進み、様々な場面でデータの利活用、正にEvidence Basedな意思決定が一般化してきました。医療分野は他分野から先行してEvidence Based Medicineが浸透していたこともあり、こうした潮流との親和性は高いと考えられます。今後、デジタル技術やデータのさらなる利活用により、新たなエコシステムの構築も伴う新規事業の立ち上げなど、様々な変革が具現化されていくものと考えられます。
こうした環境変化が急速に進む中においても、これまでと変わらず限られたリソースから最大限のリターンを獲得して持続的な存続・成長に繋げていくことは重要です。ただ、最近は効果的な投資判断や戦略検討のためにデータから示唆を得ることが一般化していますが、この一般化につれて検討のベースとなるエビデンスの質がこれまでと比してより重要になります。競合との比較を通じ、自社の強みや弱みを詳らかにしてより正確に立ち位置を把握するとともに、より明瞭に勝ち筋を見出すことに繋がるエビデンスを創出し、勝負していくための戦略策定が求められると考えられます。
医療エビデンス合成とは
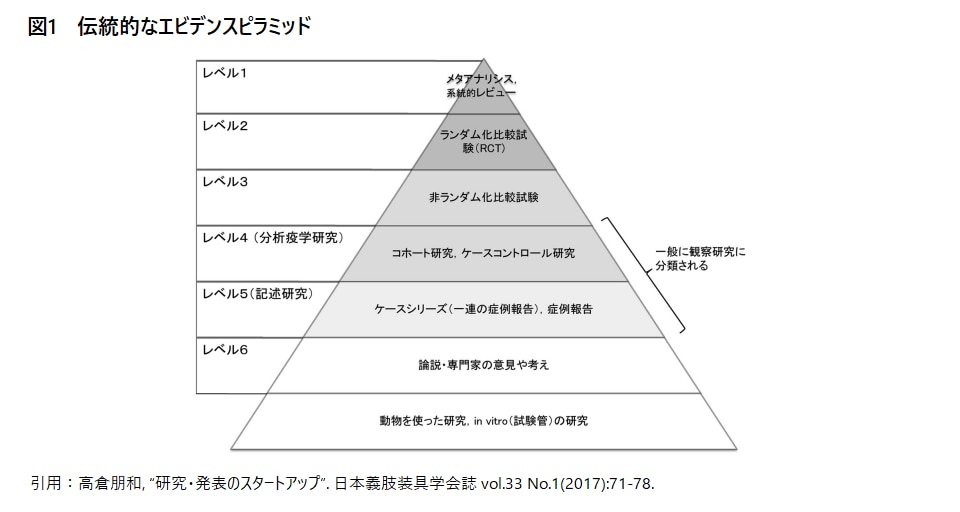
Evidence Basedな戦略や意思決定が効果的に機能するか否かは、創出するエビデンスの質に大きく依存すると考えられます。エビデンスの創出方法には様々なものがありますが、臨床研究における伝統的なエビデンスピラミッドにおいて最上位に位置し、最も強いエビデンスを創出する方法として考えられているものが医療エビデンス合成です。
医療エビデンス合成は、特定のClinical QuestionやResearch Questionに関連した様々な研究の成果を網羅的に収集し、各研究を個別に評価した上で統合する手法であり、「Systematic Literature Review」と「Meta-Analysis」から成ります。数多くの研究で以て総合的に評価することができるために、個々の研究者の手が届く範囲内で実施される研究では評価が困難な課題に対しても有用な手法であるため、診療や治療等の各種ガイドラインの作成においては必ず実施されています。
このように、医療エビデンス合成は、世界中で数々の研究者が実施した研究結果を統合して、定量・定性の両側面からClinical QuestionやResearch Questionに対する総合的な評価を実施し、1つの新たなエビデンスとして創出することができる手法となっています。
医療エビデンス合成の特徴
医療エビデンス合成の特徴は、「Systematic Literature Review」と「Meta-Analysis」から成ることからもわかるように、網羅的な研究成果の活用を通じて、定量・定性の両側面から総合的な評価が可能であることが考えられます。
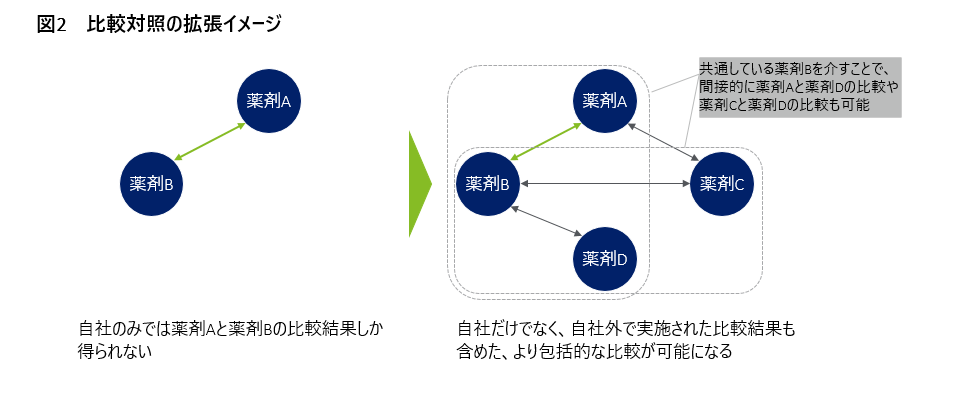
通常、1つの臨床研究では、多くは2群ないし3群でのランダム化比較試験が実施され、各群間の定量的な比較結果を得ます。医療エビデンス合成では、世界中で実施されたこうした研究を網羅的に統合した、新たなエビデンスが創出されます。例えば、個別の研究では疾患Xに対する薬剤Aと薬剤Bの比較結果からしか示唆を得られないところ、他の研究にて疾患Xに対する薬剤Aと薬剤Bや薬剤Aと薬剤C、薬剤Bと薬剤Dの比較を実施していれば、それら結果も含めて疾患Xに対する総合的な薬剤間の比較結果を得ることができます。そのため、同じ薬剤の組み合わせであれば、下図2に示すようにより多くの研究結果を統合した、より強固なエビデンスを創出することが可能であり、また直接的には比較されていない薬剤Aと薬剤Dや、薬剤Cと薬剤Dの比較についても間接的に比較することが可能であるため、疾患Xにおける興味がある薬剤の立ち位置をより明確に定量的に把握することも可能になります。
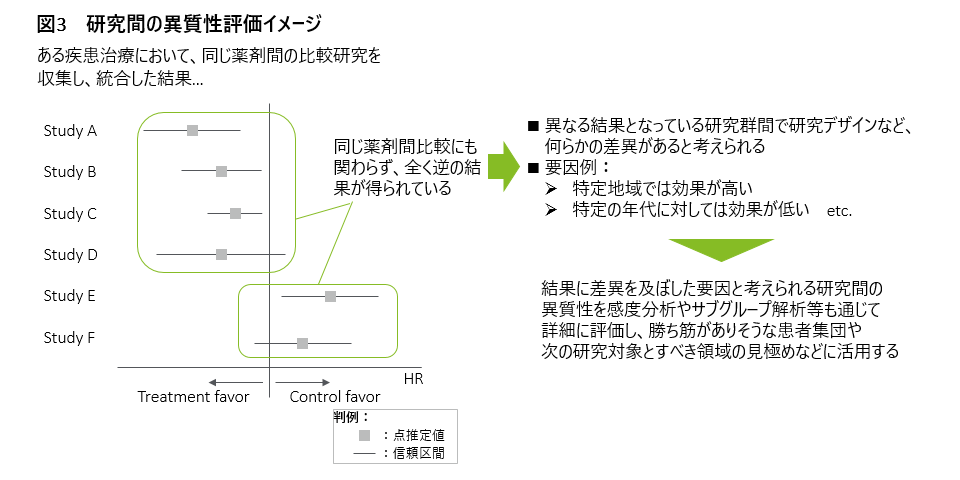
また、医療エビデンス合成では、統合に使用した研究間の異質性の評価も同時に実施することが重要になります。各研究は全く同じ研究ではないため、図3に示すように、大なり小なり結果に差異が見られます。研究対象患者集団の違いやアウトカムの収集方法の違いなどがその主たる要因となりますが、こうした差異発生要因の定性的な分析も通じて、より具体的にどの患者集団であれば勝ち筋がありそうか、まだエビデンスが不足している領域はどこなのか、など進むべき方向に係る検討に繋がる示唆も得ることが可能になると考えられます。
このように、医療エビデンス合成は、世界中で数々の研究者が実施した研究結果を統合して、定量・定性の両側面からClinical QuestionやResearch Questionに対する総合的な評価を実施し、1つの新たなエビデンスとして創出することができる手法となっています。
結語
デジタル技術の発展や導入に伴い。Evidence Basedな意思決定や戦略策定は必須となっており、ベースとなるエビデンスの質が強く問われる状況となっています。そうした中で、限られたリソースの中でも、現在の立ち位置や進むべき道に対する強力なエビデンスを創出できる医療エビデンス合成は、最も有用な手段の1つではないでしょうか。
サービス内容等に関するお問い合わせは、下記のお問い合わせフォームにて受付いたします。お気軽にお問い合わせください。

その他の記事
ライフサイエンス・ヘルスケア業界向けアナリティクスサービス
業界知見を有するデータサイエンティストがアナリティクス導入を支援